Por unanimidade, Anvisa aprova uso emergencial da CoronaVac e da vacina de Oxford/AstraZeneca
Primeiros profissionais de saúde já foram vacinados em pronunciamento do governador de São Paulo, João Doria
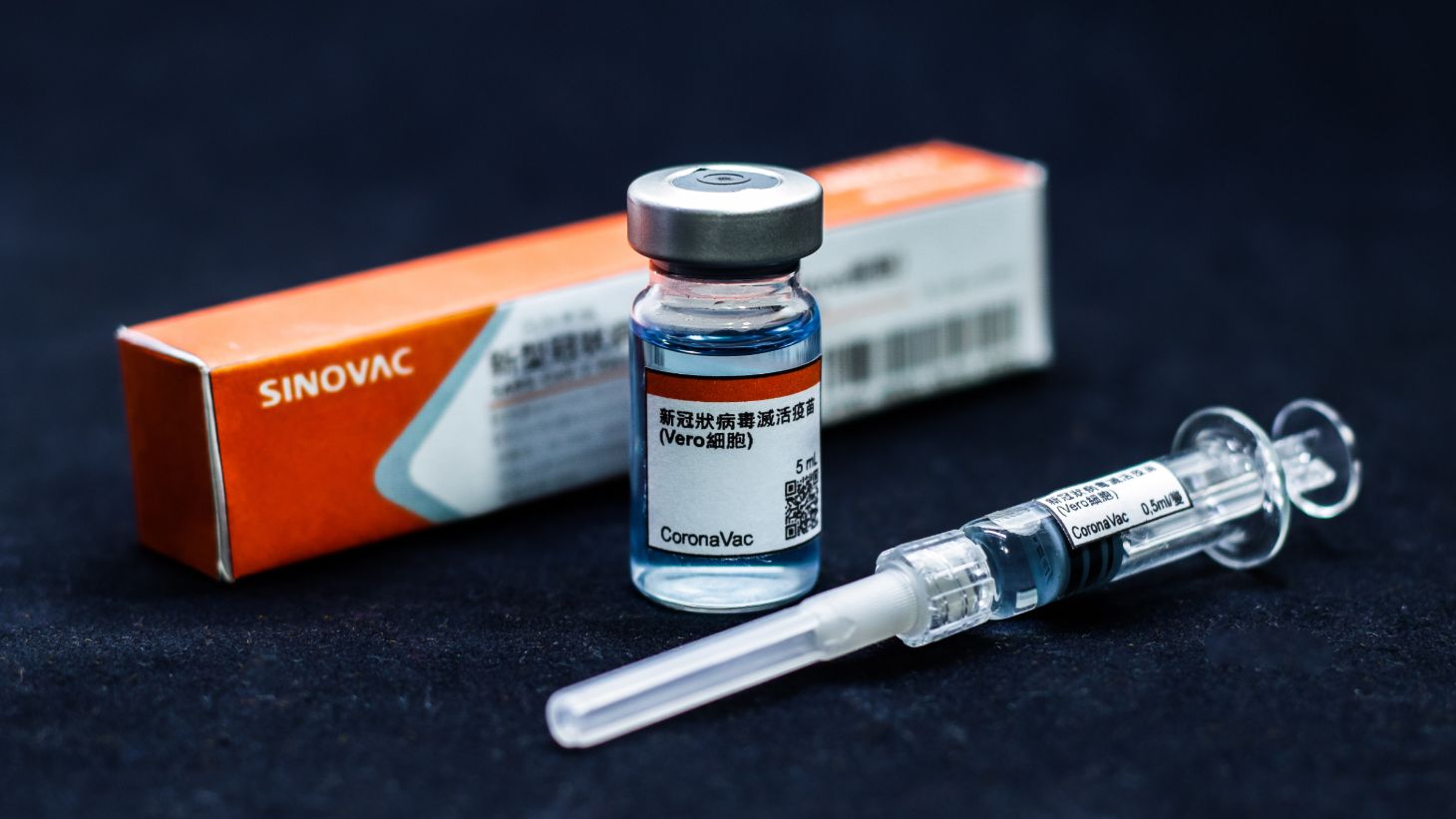
A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou, por unanimidade, na tarde deste domingo (17), o uso emergencial da CoronaVac, desenvolvida pelo laboratório chinês Sinovac em parceria com o Instituto Butantan, e da vacina desenvolvida pela Universidade de Oxford em parceria com a farmacêutica AstraZeneca.
A relatora e mais quatro diretores da agência votaram pela aprovação. A decisão depende de publicação no Diário Oficial e de comunicação aos laboratórios para entrar em vigor. No Brasil, a CoronaVac será entregue pelo Instituto Butantan, e a vacina de Oxford, pela Fiocruz.
O Instituto Butantan tem 6 milhões de doses da vacina prontas para aplicação. Elas serão encaminhadas imediatamente para o Ministério da Saúde, para que seja então iniciada a campanha nacional.
No Twitter, o governador de São Paulo, João Doria, disse que a entrega das unidades da CoronaVac prometidas para o governo federal será realizada tão logo o uso emergencial da vacina seja aprovado.
Mais cedo, o corpo técnico do órgão já havia recomendado o uso emergencial dos dois imunizantes, bem como rejeitado o pedido de uso emergencial da russa Sputnik V, que ainda não se enquadra nos requisitos mínimos para tal.
Tão logo a Anvisa aprovou o uso emergencial da CoronaVac, as primeiras doses da vacina já começaram a ser aplicadas em profissionais de saúde do estado de São Paulo no Hospital das Clínicas, na capital, no evento de pronunciamento do governador João Doria.
Leia Também
A primeira vacinada foi a enfermeira do Instituto de Infectologia Emílio Ribas, Mônica Calazans, de 54 anos, que escolheu trabalhar no local, epicentro de combate à pandemia, no auge das infecções em abril. Além de atuar na linha de frente de combate à covid-19, Mônica é do grupo de risco, sendo obesa, diabética e hipertensa.
A previsão para o início da vacinação em âmbito nacional é no dia 20 ou 21 de janeiro, mas ainda há muitas incertezas envolvendo o processo.
Como foi a votação da Anvisa
A primeira diretora a ler o voto foi a relatora do caso, Meiruze Freitas. Ela aprovou o uso emergencial, mas fez ressalvas. Disse esperar que o Instituto Butantan responda, até o fim de fevereiro, sobre os resultados sobre a imunogenicidade (capacidade de produção de anticorpos) da CoronaVac, produzida pelo Butantan em parceria com o laboratório chinês Sinovac.
A relatora destacou não haver alternativa terapêutica às vacinas. A diretora disse ter tomado a decisão com aval da ciência e após trabalho árduo dos técnicos da Anvisa nos últimos dias. “Guiada pela ciência e pelos dados, a equipe concluiu que os benefícios conhecidos e potenciais dessas vacinas superam seus riscos. Os servidores [da Anvisa] vêm trabalhando com dedicação integral e senso de urgência”, disse Meiruze ao ler o voto.
O segundo voto foi dado pelo diretor Romilson Mota, que acompanhou a relatora. De acordo com ele, o grave cenário da pandemia de covid-19 e o “indicativo de colapso” na rede de saúde justificam a aprovação.
Terceiro a votar, Alex Machado Campos acompanhou os demais diretores. Ele foi seguido pela diretora Cristiane Jourdan Gomes e pelo diretor-presidente da Anvisa, Antonio Barra Torres. A votação foi concluída por volta das 15h20.
*Com Estadão Conteúdo e Agência Brasil.
Pandemia completa 2 anos no Brasil com quase 650 mil mortes
Além das centenas de milhares de mortes, quase 30 milhões de brasileiros foram diagnosticados com covid-19 no período
Covid-19 volta a causar mais de mil mortes por dia no Brasil
Nas últimas semanas, Ministério da Saúde têm registrado sucessivamente novos recordes diários de casos da doença no Brasil
A alta estrutural do petróleo: como a questão ucraniana pode influenciar?
Tensões entre Ucrânia e Rússia podem pressionar os preços da commodity, dando uma mãozinha para o barril chegar à marca dos US$ 100
Covid-19 volta a ganhar força e Brasil bate recorde de casos confirmados da doença em 24 horas
Números de novos casos em apenas um dia ultrapassou a marca de 137 mil; Ministério da Saúde também confirmou mais 351 mortes pela doença
Com presidente do Conselho fura-quarentena e perdas de clientes, Credit Suisse tem desafio de recuperar reputação
Credit Suisse volta a ser abalado com saída de presidente do Conselho que veio para recuperar a imagem do banco, mas foi pego violando as regras da quarentena contra a covid-19
Ômicron e seus investimentos: variante do coronavírus terá efeitos distintos sobre empresas de saúde na bolsa; saiba quais são eles
Planos de saúde devem enfrentar um cenário menos favorável dado o aumento dos índices de sinistralidade e pressão sobre os custos
MacKenzie Scott, ex-mulher de fundador da Amazon, escolhe o Brasil para primeiro aporte em ONG fora dos EUA
O Vetor Brasil, organização que desenvolve profissionais para o setor público, receberá o dinheiro
Os yields devem estar loucos: entenda os impactos da alta dos juros nos EUA
2022 promete ser um ano no qual enfrentaremos o desconhecido. Não só pelos impactos da pandemia, mas também pela normalização monetária
Covid-19 volta a ameaçar planos de IPOs nos EUA
Ofertas públicas são adiadas por conta da variante Ômicron da covid-19
Depois da Azul, Latam cancela voos por casos de covid e gripe entre tripulantes
Diante dos problemas, Anac oferece suporte a passageiros afetados e monitora os casos entre profissionais da aviação
Vem aí a deltacron: Pesquisador afirma ter descoberto variante do coronavírus que mescla ômicron e delta
Autor da descoberta diz que ainda é cedo para antecipar os possíveis impactos da cepa; 25 casos foram confirmados até agora
Esquenta dos mercados: Bolsas operam mistas antes do payroll dos EUA e paralisação dos auditores da Receita pressiona governo federal
O Ibovespa ainda registra queda na casa dos 3% e o exterior morno não deve ajudar o índice brasileiro
Esquenta dos mercados: Bolsas e bitcoin (BTC) caem após ata do Fed, e Ibovespa deve aprofundar queda com risco fiscal do cenário doméstico
Os índices dos Estados Unidos tiveram uma queda expressiva ontem (05) após a divulgação do documento, e o Ibovespa, que já ia mal, piorou ainda mais
Esquenta dos mercados: Bolsas operam com cautela no exterior antes da ata do Fed e cenário doméstico permanece atento ao risco fiscal; ações de tecnologia caem lá fora após cerco da China contra setor
O coronavírus se espalha pelos países, que batem recordes de casos registrados nas últimas 24h e situação pode comprometer a retomada das atividades
Esquenta dos mercados: Bolsas do exterior sobem após dados positivos e Ibovespa deve destoar com cenário doméstico focado no risco fiscal mais uma vez
Além disso, a variante ômicron permanece no radar dos investidores internacionais, com maiores informações sobre infecções e letalidade
Anvisa recomenda suspensão da temporada de cruzeiros; três navios na costa brasileira registraram casos de covid a bordo
Dois navios interromperam as atividades na última sexta-feira, e o terceiro realizou o desembarque hoje, no Porto do Rio
Show da virada: bolsas americanas deixam Ibovespa no chinelo e encerram 2021 com ganhos de até 27%
Índices em Nova York sentem efeito do baixo volume do último dia do ano e fecham sessão abaixo dos recordes recentes. Temores por disparada de casos de covid-19 nos Estados Unidos também pesam.
Esquenta dos mercados: alerta da OMS sobre ômicron e delta atrapalha rali de final de ano nas principais bolsas mundiais
A organização alertou que a circulação simultânea das duas variantes pode provocar um tsunami de casos de covid-19
Em mais um dia fraco, Ibovespa perde força e fecha em queda; dólar volta a flertar com os R$ 5,70
Temores com a ômicron no exterior e volumes reduzidos limitaram novas altas, o que pesou na bolsa brasileira; juros e dólar responderam mal ao IGP-M e à pressão dos servidores públicos por aumentos
OMS alerta para tsunami de casos de covid-19 no mundo e manda recado ao Brasil; saiba o que a agência falou
Dois anos após primeiras notificações da China, circulação simultânea das variantes Delta e Ômicron provoca disparada global de infecções




























 SIGA O SD NO WHATSAPP
SIGA O SD NO WHATSAPP